Les études cliniques nous aident à en apprendre davantage sur les moyens de prévenir ou de traiter les pathologies médicales. La recherche doit montrer qu’un médicament à l’étude est sûr et efficace avant qu’il puisse être approuvé pour utilisation. Sans les études cliniques et les personnes qui y participent, la médecine moderne n’existerait pas.
Nous testons d’abord un vaccin ou un médicament à l’étude avec un petit groupe de participants pour comprendre sa sécurité d’emploi. Si la sécurité d’emploi est acceptable, nous testons ensuite le vaccin ou le médicament à l’étude avec un plus grand groupe de personnes pour évaluer son efficacité et continuer à examiner sa sécurité d’emploi. Cette série d’études cliniques se déroule en quatre phases principales.
Les quatre phases des études cliniques
1
En tant que participant d’une étude clinique de Phase 1, vous aidez les chercheurs à comprendre la sécurité d'emploi d’un médicament à l’étude. Vous pourriez passer de fréquents examens cliniques et analyses de laboratoire, et l’on vous demandera de signaler tout problème ou effet secondaire.


2
En rejoignant une étude clinique de Phase 2, vous aidez les chercheurs à mieux comprendre dans quelle mesure le médicament à l’étude peut agir sur la maladie étudiée, et les effets secondaires qui peuvent survenir.


3
Dans une étude clinique de Phase 3, vous faites partie d’un plus grand groupe de personnes atteintes de la pathologie étudiée. Votre participation aide les chercheurs à déterminer si le médicament à l’étude est sûr et efficace pour les personnes atteintes de cette pathologie.


4
Même une fois que l’utilisation des médicaments est approuvée, vous pouvez continuer à participer à des études cliniques à long terme conçues pour mieux comprendre les effets du médicament approuvé au fil du temps.


 Soumission
Soumission
 Revue
Revue
 Approbation
Approbation
 Disponible pour les patients
Disponible pour les patients
Comment les études cliniques sont-elles conçues ?
Protocole
Les études cliniques commencent par un protocole. Un protocole est un plan détaillé qui explique l’objectif de l’étude clinique et comment il sera exécuté. Il comprend :

la durée de l’étude clinique ;

les informations concernant les personnes qui peuvent y participer ;

les médicaments à l’étude, les procédures et les tests réalisés dans le cadre de l’étude clinique ;

la manière dont les effets secondaires seront suivis, pris en charge et rapportés ;

le calendrier des activités durant l’étude ;

les règles qui doivent être suivies.
Le protocole décrira également si l’étude clinique :
- est randomisée
- est contrôlée
- est réalisée en aveugle
Randomisation
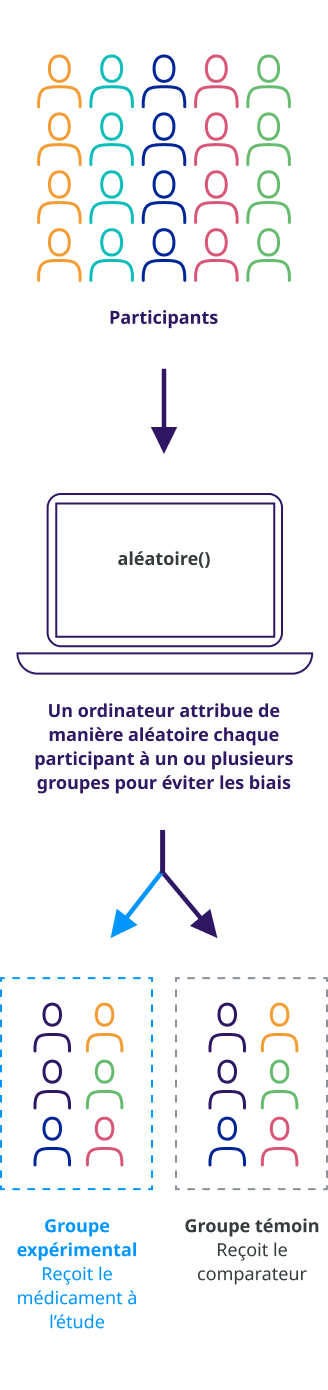
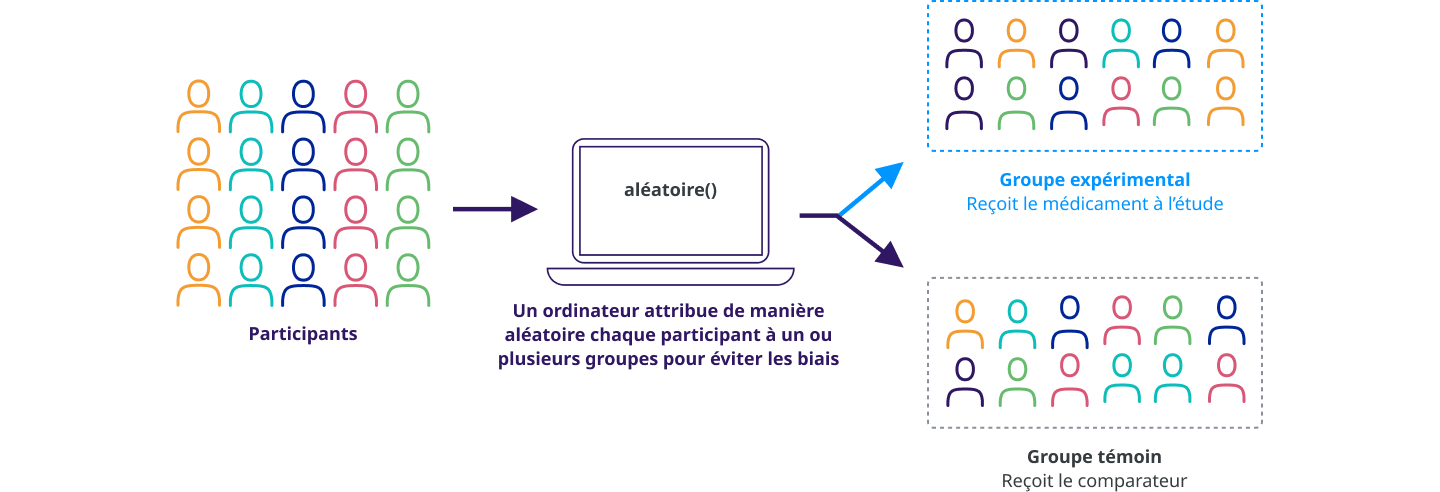
Les participants sont affectés à différents groupes de traitement dans une étude clinique par un processus appelé randomisation. La randomisation signifie que les participants sont affectés à un groupe de traitement au hasard (comme à pile ou face) plutôt que par choix.
La randomisation est une façon d’éviter les biais dans une étude. Par exemple, cela permet de s’assurer que les personnes du même sexe ou du même âge ne sont pas toutes affectées au même groupe de traitement.
Étude contrôlée
Une étude contrôlée est une étude clinique qui comprend un groupe de comparaison (témoin). Dans les études cliniques contrôlées, les participants sont placés dans des groupes qui reçoivent le médicament à l’étude ou un « comparateur ». Nous évaluons l’efficacité et la sécurité d’emploi du médicament à l’étude en comparant les expériences des participants qui reçoivent le médicament à l’étude avec celles des participants qui reçoivent le comparateur.
Un exemple courant d’un comparateur est le « traitement standard », c’est-à-dire le traitement établi qui est couramment utilisé pour une pathologie.
Dans une étude contrôlée « en double aveugle », des placebos sont utilisés pour éviter que le participant et l’équipe de l’étude sachent si le participant reçoit le médicament à l’étude ou le comparateur. Un placebo ne contient pas de principes actifs, mais le médicament à l’étude et le placebo se ressemblent. Apprenez-en davantage sur les études en simple aveugle et en double aveugle ci-dessous.
Études cliniques en simple aveugle ou en double aveugle
Les études cliniques peuvent être en simple aveugle ou en double aveugle.
Dans une étude en simple aveugle, les participants ne savent pas s’ils reçoivent le médicament à l’étude ou le placebo, mais les chercheurs le savent.
Dans les études en double aveugle, ni les participants ni les chercheurs ne savent si les participants reçoivent le médicament à l’étude ou le placebo. (Si nécessaire, par exemple pour des raisons de sécurité, les chercheurs peuvent savoir ce qu’un participant a reçu.)
Les études cliniques utilisent l’aveugle pour aider à prévenir les biais. De cette façon, le fait de savoir dans quel groupe de traitement se trouve un participant n’influence pas le participant ni l’équipe de l’étude.
La levée de l’aveugle est réalisée pour toutes les études cliniques une fois qu’elles sont terminées ou que l’aveugle n’est plus nécessaire. Lors de la levée de l’aveugle d’une étude, le groupe de traitement attribué est révélé pour chaque participant.